Meitner to niezwykle radioaktywny, syntetyczny pierwiastek (czyli nie występujący w naturze, ale za to możliwy do wytworzenia) o liczbie atomowej 109.
W układzie okresowym meitner jest pierwiastkiem d-blokowym transaktynowym. Jest członkiem siódmego okresu i jest umieszczony w grupie 9 pierwiastków, chociaż nie przeprowadzono jeszcze eksperymentów chemicznych, aby potwierdzić, że zachowuje się jak cięższy homolog irydu w grupie 9 jako siódmy członek serii 6d metali przejściowych. Oblicza się, że meitner ma podobne właściwości do swoich lżejszych homologów, kobaltu, rodu i irydu.
O historii odkrycia słów klika...
Meitner zostało po raz pierwszy zsyntetyzowany 29 sierpnia 1982 roku przez niemiecki zespół badawczy kierowany przez Petera Armbrustera i Gottfrieda Münzenberga w Instytucie Badań Ciężkich Jonów (Gesellschaft für Schwerionenforschung) w Darmstadt. Zespół zbombardował tarczę bizmutu-209 przyspieszonymi jądrami żelaza-58 i wykrył pojedynczy atom izotopu meitneru-266:
Praca ta została potwierdzona trzy lata później we Wspólnym Instytucie Badań Jądrowych w Dubnej (wówczas w Związku Radzieckim).
A dlaczego nazwa "meitner"?
Używając nomenklatury Mendelejewa dla nienazwanych i nieodkrytych pierwiastków, meitner powinien być znany jako eka-iridium. W 1979 roku, podczas wojen transferowych, IUPAC opublikował zalecenia, zgodnie z którymi pierwiastek miał być nazywany unnilennium (z odpowiednim symbolem Une), systematyczna nazwa pierwiastka jako zastępcza, do czasu odkrycia pierwiastka (a następnie potwierdzenia odkrycia) i podjęcia decyzji o stałej nazwie. Chociaż zalecenia te były szeroko stosowane w społeczności chemicznej na wszystkich poziomach, od klas chemicznych po zaawansowane podręczniki, zostały one w większości zignorowane przez naukowców w tej dziedzinie, którzy albo nazwali go "pierwiastkiem 109", z symbolem E109 lub nawet po prostu 109, albo użyli proponowanej nazwy "meitnerium”.
 Nazwa meitner była dyskutowana w kontrowersjach dotyczących nazewnictwa pierwiastków od 104 do 109, ale meitner był jedyną propozycją i dlatego nigdy nie został zakwestionowany .Nazwa meitner (Mt) została zaproponowana przez zespół GSI we wrześniu 1992 roku na cześć austriackiej fizyczki Lise Meitner, współodkrywczyni protaktynu i jednego z odkrywców rozszczepienia jądra atomowego. W 1994 r. nazwa ta została zarekomendowana przez IUPAC i została oficjalnie przyjęta w 1997 r.
Nazwa meitner była dyskutowana w kontrowersjach dotyczących nazewnictwa pierwiastków od 104 do 109, ale meitner był jedyną propozycją i dlatego nigdy nie został zakwestionowany .Nazwa meitner (Mt) została zaproponowana przez zespół GSI we wrześniu 1992 roku na cześć austriackiej fizyczki Lise Meitner, współodkrywczyni protaktynu i jednego z odkrywców rozszczepienia jądra atomowego. W 1994 r. nazwa ta została zarekomendowana przez IUPAC i została oficjalnie przyjęta w 1997 r.
Czy taki pierwiastek ma swoje izotopy?
Meitner nie posiada stabilnych lub naturalnie występujących izotopów. Kilka radioaktywnych izotopów zostało zsyntetyzowanych w laboratorium, poprzez stopienie dwóch atomów lub obserwację rozpadu cięższych pierwiastków. Zgłoszono osiem różnych izotopów meitneru o liczbach masowych 266, 268, 270 i 274-278, z których dwa, meitner-268 i meitner-270, mają niepotwierdzone stany metastabilne. Dziewiąty izotop o liczbie masowej 282 jest niepotwierdzony. Większość z nich rozpada się głównie poprzez rozpad alfa, chociaż niektóre ulegają spontanicznemu rozszczepieniu
Wszystkie izotopy mejtneru są niezwykle niestabilne i radioaktywne; ogólnie rzecz biorąc, cięższe izotopy są bardziej stabilne niż lżejsze. Najbardziej stabilny znany izotop meitneru, 278-Mt, jest również najcięższym znanym izotopem; jego okres połowicznego rozpadu wynosi 4,5 sekundy. Niepotwierdzony izotop 282-Mt jest jeszcze cięższy i wydaje się mieć dłuższy okres półtrwania wynoszący 67 sekund. Izotopy 276-Mt i 274-Mt mają okresy połowicznego rozpadu wynoszące odpowiednio 0,62 i 0,64 sekundy. Pozostałe pięć izotopów ma okresy połowicznego rozpadu wynoszące od 1 do 20 milisekund.
Zaobserwowano, że izotop 277-Mt, powstały jako końcowy produkt rozpadu 293-Ts po raz pierwszy w 2012 roku, uległ spontanicznemu rozszczepieniu z okresem połowicznego rozpadu wynoszącym 5 milisekund. Wstępna analiza danych uwzględniła możliwość, że rozszczepienie to może pochodzić od 277-Hs, który również ma okres połowicznego rozpadu wynoszący kilka milisekund i mógłby zostać zapełniony po niewykrytym wychwycie elektronów gdzieś w łańcuchu rozpadu. Możliwość ta została później uznana za bardzo mało prawdopodobną w oparciu o obserwowane energie rozpadu 281-Ds i 281-Rg oraz krótki czas połowicznego rozpadu 277-Mt, chociaż nadal istnieją pewne niepewności co do tej kwestii. Niezależnie od tego, szybkie rozszczepienie 277-Mt i 277-Hs silnie sugeruje istnienie obszaru niestabilności dla superciężkich jąder o N = 168-170. Istnienie tego obszaru, charakteryzującego się spadkiem wysokości bariery rozszczepienia między zdeformowanym zamknięciem powłoki przy N = 162 a sferycznym zamknięciem powłoki przy N = 184, jest zgodne z modelami teoretycznymi.
Jakie właściwości może mieć meitner?
Poza właściwościami jądrowymi, żadne właściwości meitneru lub jego związków nie zostały zmierzone; jest to spowodowane jego niezwykle ograniczoną i kosztowną produkcją oraz faktem, że meitner i jego związki macierzyste rozpadają się bardzo szybko. Właściwości metalu meitneru pozostają nieznane i dostępne są jedynie przewidywania.
Przewidywaniu prawdopodobnych właściwości chemicznych meitneru nie poświęcono ostatnio zbyt wiele uwagi. Oczekuje się, że meitner będzie metalem szlachetnym. Oczekuje się, że standardowy potencjał elektrody dla pary Mt3+/Mt będzie wynosił 0,8 V. W oparciu o najbardziej stabilne stopnie utlenienia lżejszych pierwiastków z grupy 9, przewiduje się, że najbardziej stabilnymi stopniami utlenienia meitnerium będą stany +6, +3 i +1, przy czym stan +3 będzie najbardziej stabilny w roztworach wodnych. Dla porównania, rod i iryd wykazują maksymalny stopień utlenienia +6, podczas gdy najbardziej stabilne stany to +4 i +3 dla irydu i +3 dla rodu.Stopień utlenienia +9, reprezentowany tylko przez iryd w [IrO4]+, może być możliwy dla jego kongenera meitneru w bezfluorku (MtF9) i kationie [MtO4]+, chociaż oczekuje się, że [IrO4]+ będzie bardziej stabilny niż te związki meitneru. Przewiduje się również, że tetrahalogenki meitneru będą miały podobną stabilność do irydu, umożliwiając tym samym stabilny stan +4. Oczekuje się ponadto, że maksymalne stopnie utlenienia pierwiastków od bohru do darmsztadtu mogą być stabilne w fazie gazowej, ale nie w roztworze wodnym.
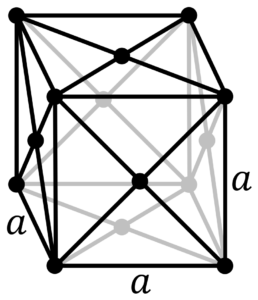 Oczekuje się, że meitner będzie ciałem stałym w normalnych warunkach i przyjmie sześcienną strukturę krystaliczną, podobnie jak jego lżejszy kongener iryd.. Powinien być bardzo ciężkim metalem o gęstości około 27-28 g/cm3, co byłoby jednym z najwyższych spośród 118 znanych pierwiastków. Przewiduje się również, że meitner będzie paramagnetyczny jak i promień kowalencyjny meitneru będzie od 6 do 10 pm większy niż promień irydu, zaś jego promień atomowy ma wynosić około 128 pm.
Oczekuje się, że meitner będzie ciałem stałym w normalnych warunkach i przyjmie sześcienną strukturę krystaliczną, podobnie jak jego lżejszy kongener iryd.. Powinien być bardzo ciężkim metalem o gęstości około 27-28 g/cm3, co byłoby jednym z najwyższych spośród 118 znanych pierwiastków. Przewiduje się również, że meitner będzie paramagnetyczny jak i promień kowalencyjny meitneru będzie od 6 do 10 pm większy niż promień irydu, zaś jego promień atomowy ma wynosić około 128 pm.
Tekst i redakcja: Maciej Gdala