Start - Aktualności
Autor: System Publikacja: 23.03.2020
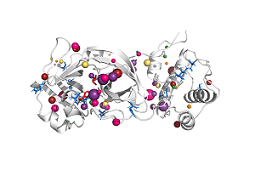
Młody zespół działający pod kierunkiem dra hab. Artura Góry z Centrum Biotechnologii Politechniki Śląskiej w ramach nawiązanej współpracy z badaczami z Uniwersytetu Alberty w Kanadzie oraz Politechniki w Turynie scharakteryzował główną proteazę SARS-CoV-2 (SARS-CoV-2 Mpro) oraz porównał ją z odpowiadającym enzymem wirusa wywołującego SARS (SARS-CoV Mpro).
– Początkowo chcieliśmy porównać zachowanie obu enzymów i na tej podstawie zaproponować związki, które były już wcześniej przebadane i mogłyby szybko zostać wprowadzone, aby zahamować aktywność głównej proteazy, a tym samym zahamować namnażanie się wirusa. Niestety, już podczas wstępnych analiz okazało się, że kieszeń wiążąca substrat, w której miałoby następować wiązanie związków hamujących działanie enzymu, jest bardzo ruchliwa. Co oznacza, że nie możemy skorzystać z drogi na skróty – opowiada o wynikach badań dr hab. Artur Góra. – Dodatkowo zaobserwowaliśmy, że nasz cel molekularny może łatwo ulec dalszym zmianom, gdyż charakteryzuje się dużą zmiennością ewolucyjną – dodaje. – To w efekcie oznaczałoby, że cały nasz i naszych Partnerów wysiłek może pójść na marne. Dlatego też niezwłocznie rozpoczęliśmy prace nad wytypowaniem innego – mniej ruchliwego i ewolucyjnie stabilnego – rejonu białka Mpro, do którego potencjalne leki mogłyby się wiązać skuteczniej – mówi dr hab. inż. Artur Góra.
– Poprzez połączenie analizy dynamiki białka z analizą ewolucyjną oraz analizą wpływu dalszych mutacji na stabilność enzymu chcemy wygrać ten szczególnego rodzaju wyścig zbrojeń, inaczej mówiąc chcemy przechytrzyć wirusa i przewidzieć kolejne możliwe drogi jego ewolucji. Już teraz wiemy, że wirus wyizolowany we Włoszech różni się od tego z Wuhan. Mutacje prowadzące do zmian w sekwencji głównej proteazy to także tylko kwestia czasu i chcemy być na tę ewentualność dobrze przygotowani – opowiada. – Nasze prace nie są wyłącznie teoretyczne, skuteczność wiązania się wytypowanych związków możemy błyskawicznie sprawdzić dzięki nowoczesnej platformie do wysokoprzepustowej analizy interakcji międzycząsteczkowych dostarczonej przez firmę NanoTemper. Możemy mówić o dużym szczęściu w tej sytuacji, grant na pozyskanie unikalnej infrastruktury badawczej otrzymaliśmy pod koniec zeszłego roku i przy wykorzystaniu MonolithNT.Automated jesteśmy w stanie zweryfikować kilkaset związków dziennie.
Prace w kierunku scharakteryzowania SARS-CoV-2 Mpro ruszyły w momencie, kiedy udostępniona została struktura krystalograficzna tego białka. Na jej podstawie wykonane zostały symulacje dynamiki molekularnej, które następnie przeanalizowano pod kątem zmian dynamiki i zachowania białka. Grupa Tunneling Group stworzyła program AQUA-DUCT, który pozwala na przeanalizowanie dynamiki zachowania białka z uwzględnieniem zmian w dostępnych przestrzeniach wewnątrzcząsteczkowych, co przy konwencjonalnej analizie jest zwykle pomijane. Dodatkowo, badania zostały rozszerzone o analizę ewolucyjną wirusowych białek Mpro oraz badanie stabilności białka. Pierwsze wyniki badań zespołu dra Góry zostały udostępnione dla wszystkich zainteresowanych już na początku marca, czekają również na recenzje w jednym z topowych czasopism.
W zespole badawczym z ramienia Politechniki Śląskiej pracują: dr hab. Artur Góra z Centrum Biotechnologii, doktorantki - mgr Karolina Mitusińska z Centrum Biotechnologii i Wydziału Chemicznego, mgr inż. Maria Bzówka ze Wspólnej Szkoły Doktorskiej, oraz inż. Agata Raczyńska i inż. Aleksandra Samol z Wydziału Automatyki, Elektroniki i Informatyki.
Naukowcy z Politechniki Śląskiej w międzynarodowym zespole pracują nad jednym z kluczowych enzymów wirusa SARS-CoV-2
Nowoczesne metody obliczeniowe pozwalają na znaczne przyspieszenie badań pozwalających poznać strukturę i funkcję białek – również wirusowych, a w efekcie służą jako pomoc w zaprojektowaniu skutecznych leków czy szczepionek. Naukowcy z grupy badawczej Tunneling Group, działającej przy Centrum Biotechnologii Politechniki Śląskiej, wykorzystując symulacje dynamiki molekularnej i autorskie oprogramowanie, dogłębnie poznali strukturę głównej proteazy wirusa SARS-CoV-2, enzymu, który jest jednym z kluczowych enzymów w cyklu życiowym wirusa.
Młody zespół działający pod kierunkiem dra hab. Artura Góry z Centrum Biotechnologii Politechniki Śląskiej w ramach nawiązanej współpracy z badaczami z Uniwersytetu Alberty w Kanadzie oraz Politechniki w Turynie scharakteryzował główną proteazę SARS-CoV-2 (SARS-CoV-2 Mpro) oraz porównał ją z odpowiadającym enzymem wirusa wywołującego SARS (SARS-CoV Mpro).
– Początkowo chcieliśmy porównać zachowanie obu enzymów i na tej podstawie zaproponować związki, które były już wcześniej przebadane i mogłyby szybko zostać wprowadzone, aby zahamować aktywność głównej proteazy, a tym samym zahamować namnażanie się wirusa. Niestety, już podczas wstępnych analiz okazało się, że kieszeń wiążąca substrat, w której miałoby następować wiązanie związków hamujących działanie enzymu, jest bardzo ruchliwa. Co oznacza, że nie możemy skorzystać z drogi na skróty – opowiada o wynikach badań dr hab. Artur Góra. – Dodatkowo zaobserwowaliśmy, że nasz cel molekularny może łatwo ulec dalszym zmianom, gdyż charakteryzuje się dużą zmiennością ewolucyjną – dodaje. – To w efekcie oznaczałoby, że cały nasz i naszych Partnerów wysiłek może pójść na marne. Dlatego też niezwłocznie rozpoczęliśmy prace nad wytypowaniem innego – mniej ruchliwego i ewolucyjnie stabilnego – rejonu białka Mpro, do którego potencjalne leki mogłyby się wiązać skuteczniej – mówi dr hab. inż. Artur Góra.
– Poprzez połączenie analizy dynamiki białka z analizą ewolucyjną oraz analizą wpływu dalszych mutacji na stabilność enzymu chcemy wygrać ten szczególnego rodzaju wyścig zbrojeń, inaczej mówiąc chcemy przechytrzyć wirusa i przewidzieć kolejne możliwe drogi jego ewolucji. Już teraz wiemy, że wirus wyizolowany we Włoszech różni się od tego z Wuhan. Mutacje prowadzące do zmian w sekwencji głównej proteazy to także tylko kwestia czasu i chcemy być na tę ewentualność dobrze przygotowani – opowiada. – Nasze prace nie są wyłącznie teoretyczne, skuteczność wiązania się wytypowanych związków możemy błyskawicznie sprawdzić dzięki nowoczesnej platformie do wysokoprzepustowej analizy interakcji międzycząsteczkowych dostarczonej przez firmę NanoTemper. Możemy mówić o dużym szczęściu w tej sytuacji, grant na pozyskanie unikalnej infrastruktury badawczej otrzymaliśmy pod koniec zeszłego roku i przy wykorzystaniu MonolithNT.Automated jesteśmy w stanie zweryfikować kilkaset związków dziennie.
Prace w kierunku scharakteryzowania SARS-CoV-2 Mpro ruszyły w momencie, kiedy udostępniona została struktura krystalograficzna tego białka. Na jej podstawie wykonane zostały symulacje dynamiki molekularnej, które następnie przeanalizowano pod kątem zmian dynamiki i zachowania białka. Grupa Tunneling Group stworzyła program AQUA-DUCT, który pozwala na przeanalizowanie dynamiki zachowania białka z uwzględnieniem zmian w dostępnych przestrzeniach wewnątrzcząsteczkowych, co przy konwencjonalnej analizie jest zwykle pomijane. Dodatkowo, badania zostały rozszerzone o analizę ewolucyjną wirusowych białek Mpro oraz badanie stabilności białka. Pierwsze wyniki badań zespołu dra Góry zostały udostępnione dla wszystkich zainteresowanych już na początku marca, czekają również na recenzje w jednym z topowych czasopism.
W zespole badawczym z ramienia Politechniki Śląskiej pracują: dr hab. Artur Góra z Centrum Biotechnologii, doktorantki - mgr Karolina Mitusińska z Centrum Biotechnologii i Wydziału Chemicznego, mgr inż. Maria Bzówka ze Wspólnej Szkoły Doktorskiej, oraz inż. Agata Raczyńska i inż. Aleksandra Samol z Wydziału Automatyki, Elektroniki i Informatyki.
#PŚpomagamy
Aktualności
Pokaż wszystkie



Otwarte zasoby edukacyjne
Nie byłoby otwartej edukacji, gdyby nie rozwijająca się technologia. Warto więc zastanowić się, jak wykorzystać nowe narzędzia do usprawniania systemu edukacyjnego, co pośrednio może mieć wpływ na zbliżenia szkoły do rzeczywistości spoza szkolnych murów.

IBUK Libra 2025/2026
Zapraszamy do korzystania z platformy książek elektronicznych IBUK Libra.
Więcej aktualności Mniej aktualności