Start - News
Author: System Published at: 23.03.2020
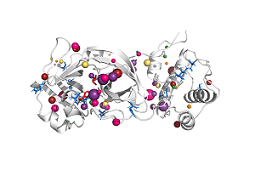
Młody zespół działający pod kierunkiem dra hab. Artura Góry z Centrum Biotechnologii Politechniki Śląskiej w ramach nawiązanej współpracy z badaczami z Uniwersytetu Alberty w Kanadzie oraz Politechniki w Turynie scharakteryzował główną proteazę SARS-CoV-2 (SARS-CoV-2 Mpro) oraz porównał ją z odpowiadającym enzymem wirusa wywołującego SARS (SARS-CoV Mpro).
– Początkowo chcieliśmy porównać zachowanie obu enzymów i na tej podstawie zaproponować związki, które były już wcześniej przebadane i mogłyby szybko zostać wprowadzone, aby zahamować aktywność głównej proteazy, a tym samym zahamować namnażanie się wirusa. Niestety, już podczas wstępnych analiz okazało się, że kieszeń wiążąca substrat, w której miałoby następować wiązanie związków hamujących działanie enzymu, jest bardzo ruchliwa. Co oznacza, że nie możemy skorzystać z drogi na skróty – opowiada o wynikach badań dr hab. Artur Góra. – Dodatkowo zaobserwowaliśmy, że nasz cel molekularny może łatwo ulec dalszym zmianom, gdyż charakteryzuje się dużą zmiennością ewolucyjną – dodaje. – To w efekcie oznaczałoby, że cały nasz i naszych Partnerów wysiłek może pójść na marne. Dlatego też niezwłocznie rozpoczęliśmy prace nad wytypowaniem innego – mniej ruchliwego i ewolucyjnie stabilnego – rejonu białka Mpro, do którego potencjalne leki mogłyby się wiązać skuteczniej – mówi dr hab. inż. Artur Góra.
– Poprzez połączenie analizy dynamiki białka z analizą ewolucyjną oraz analizą wpływu dalszych mutacji na stabilność enzymu chcemy wygrać ten szczególnego rodzaju wyścig zbrojeń, inaczej mówiąc chcemy przechytrzyć wirusa i przewidzieć kolejne możliwe drogi jego ewolucji. Już teraz wiemy, że wirus wyizolowany we Włoszech różni się od tego z Wuhan. Mutacje prowadzące do zmian w sekwencji głównej proteazy to także tylko kwestia czasu i chcemy być na tę ewentualność dobrze przygotowani – opowiada. – Nasze prace nie są wyłącznie teoretyczne, skuteczność wiązania się wytypowanych związków możemy błyskawicznie sprawdzić dzięki nowoczesnej platformie do wysokoprzepustowej analizy interakcji międzycząsteczkowych dostarczonej przez firmę NanoTemper. Możemy mówić o dużym szczęściu w tej sytuacji, grant na pozyskanie unikalnej infrastruktury badawczej otrzymaliśmy pod koniec zeszłego roku i przy wykorzystaniu MonolithNT.Automated jesteśmy w stanie zweryfikować kilkaset związków dziennie.
Prace w kierunku scharakteryzowania SARS-CoV-2 Mpro ruszyły w momencie, kiedy udostępniona została struktura krystalograficzna tego białka. Na jej podstawie wykonane zostały symulacje dynamiki molekularnej, które następnie przeanalizowano pod kątem zmian dynamiki i zachowania białka. Grupa Tunneling Group stworzyła program AQUA-DUCT, który pozwala na przeanalizowanie dynamiki zachowania białka z uwzględnieniem zmian w dostępnych przestrzeniach wewnątrzcząsteczkowych, co przy konwencjonalnej analizie jest zwykle pomijane. Dodatkowo, badania zostały rozszerzone o analizę ewolucyjną wirusowych białek Mpro oraz badanie stabilności białka. Pierwsze wyniki badań zespołu dra Góry zostały udostępnione dla wszystkich zainteresowanych już na początku marca, czekają również na recenzje w jednym z topowych czasopism.
W zespole badawczym z ramienia Politechniki Śląskiej pracują: dr hab. Artur Góra z Centrum Biotechnologii, doktorantki - mgr Karolina Mitusińska z Centrum Biotechnologii i Wydziału Chemicznego, mgr inż. Maria Bzówka ze Wspólnej Szkoły Doktorskiej, oraz inż. Agata Raczyńska i inż. Aleksandra Samol z Wydziału Automatyki, Elektroniki i Informatyki.
Naukowcy z Politechniki Śląskiej w międzynarodowym zespole pracują nad jednym z kluczowych enzymów wirusa SARS-CoV-2
Nowoczesne metody obliczeniowe pozwalają na znaczne przyspieszenie badań pozwalających poznać strukturę i funkcję białek – również wirusowych, a w efekcie służą jako pomoc w zaprojektowaniu skutecznych leków czy szczepionek. Naukowcy z grupy badawczej Tunneling Group, działającej przy Centrum Biotechnologii Politechniki Śląskiej, wykorzystując symulacje dynamiki molekularnej i autorskie oprogramowanie, dogłębnie poznali strukturę głównej proteazy wirusa SARS-CoV-2, enzymu, który jest jednym z kluczowych enzymów w cyklu życiowym wirusa.
Młody zespół działający pod kierunkiem dra hab. Artura Góry z Centrum Biotechnologii Politechniki Śląskiej w ramach nawiązanej współpracy z badaczami z Uniwersytetu Alberty w Kanadzie oraz Politechniki w Turynie scharakteryzował główną proteazę SARS-CoV-2 (SARS-CoV-2 Mpro) oraz porównał ją z odpowiadającym enzymem wirusa wywołującego SARS (SARS-CoV Mpro).
– Początkowo chcieliśmy porównać zachowanie obu enzymów i na tej podstawie zaproponować związki, które były już wcześniej przebadane i mogłyby szybko zostać wprowadzone, aby zahamować aktywność głównej proteazy, a tym samym zahamować namnażanie się wirusa. Niestety, już podczas wstępnych analiz okazało się, że kieszeń wiążąca substrat, w której miałoby następować wiązanie związków hamujących działanie enzymu, jest bardzo ruchliwa. Co oznacza, że nie możemy skorzystać z drogi na skróty – opowiada o wynikach badań dr hab. Artur Góra. – Dodatkowo zaobserwowaliśmy, że nasz cel molekularny może łatwo ulec dalszym zmianom, gdyż charakteryzuje się dużą zmiennością ewolucyjną – dodaje. – To w efekcie oznaczałoby, że cały nasz i naszych Partnerów wysiłek może pójść na marne. Dlatego też niezwłocznie rozpoczęliśmy prace nad wytypowaniem innego – mniej ruchliwego i ewolucyjnie stabilnego – rejonu białka Mpro, do którego potencjalne leki mogłyby się wiązać skuteczniej – mówi dr hab. inż. Artur Góra.
– Poprzez połączenie analizy dynamiki białka z analizą ewolucyjną oraz analizą wpływu dalszych mutacji na stabilność enzymu chcemy wygrać ten szczególnego rodzaju wyścig zbrojeń, inaczej mówiąc chcemy przechytrzyć wirusa i przewidzieć kolejne możliwe drogi jego ewolucji. Już teraz wiemy, że wirus wyizolowany we Włoszech różni się od tego z Wuhan. Mutacje prowadzące do zmian w sekwencji głównej proteazy to także tylko kwestia czasu i chcemy być na tę ewentualność dobrze przygotowani – opowiada. – Nasze prace nie są wyłącznie teoretyczne, skuteczność wiązania się wytypowanych związków możemy błyskawicznie sprawdzić dzięki nowoczesnej platformie do wysokoprzepustowej analizy interakcji międzycząsteczkowych dostarczonej przez firmę NanoTemper. Możemy mówić o dużym szczęściu w tej sytuacji, grant na pozyskanie unikalnej infrastruktury badawczej otrzymaliśmy pod koniec zeszłego roku i przy wykorzystaniu MonolithNT.Automated jesteśmy w stanie zweryfikować kilkaset związków dziennie.
Prace w kierunku scharakteryzowania SARS-CoV-2 Mpro ruszyły w momencie, kiedy udostępniona została struktura krystalograficzna tego białka. Na jej podstawie wykonane zostały symulacje dynamiki molekularnej, które następnie przeanalizowano pod kątem zmian dynamiki i zachowania białka. Grupa Tunneling Group stworzyła program AQUA-DUCT, który pozwala na przeanalizowanie dynamiki zachowania białka z uwzględnieniem zmian w dostępnych przestrzeniach wewnątrzcząsteczkowych, co przy konwencjonalnej analizie jest zwykle pomijane. Dodatkowo, badania zostały rozszerzone o analizę ewolucyjną wirusowych białek Mpro oraz badanie stabilności białka. Pierwsze wyniki badań zespołu dra Góry zostały udostępnione dla wszystkich zainteresowanych już na początku marca, czekają również na recenzje w jednym z topowych czasopism.
W zespole badawczym z ramienia Politechniki Śląskiej pracują: dr hab. Artur Góra z Centrum Biotechnologii, doktorantki - mgr Karolina Mitusińska z Centrum Biotechnologii i Wydziału Chemicznego, mgr inż. Maria Bzówka ze Wspólnej Szkoły Doktorskiej, oraz inż. Agata Raczyńska i inż. Aleksandra Samol z Wydziału Automatyki, Elektroniki i Informatyki.
#PŚpomagamy
News
Show all





Show more Less items
Events
Show allCooperation:

Santander Universidades to jeden z fundamentów społecznego zaangażowania Banku Zachodniego BZWBK oraz Grupy Santander.
Cooperation:

Santander Universidades to jeden z fundamentów społecznego zaangażowania Banku Zachodniego BZWBK oraz Grupy Santander.